近日,动物科技学院(动物医学院)师科荣课题组在Cell & Bioscience在线发表了题为“Menin orchestrates hepatic glucose and fatty acid uptake via deploying the cellular translocation of SIRT1 and PPARγ”的研究论文。在读博士生刘廷俊和已毕业硕士李冉冉为该论文的第一作者,师科荣副教授为论文的通讯作者。
非酒精性脂肪肝(NAFLD)居于肝病之首,在全球成年人中有近1/4的发病率。NAFLD是一种以非酒精因素导致的肝细胞内脂肪过度沉积为主要特征的临床病理综合征,往往与营养过剩所致的体重增长过快、肥胖、糖尿病、高脂血症等引起的胰岛素抵抗和遗传易感性密切相关,是一种获得性代谢应激性肝损伤。肝细胞的代谢稳态对于肝脏乃至整个机体的代谢平衡举足轻重。
Menin是由Men1基因编码的支架蛋白,以“抑癌基因”的角色募集丰富的转录因子(互作)参与基因的表观遗传修饰,通过激活或抑制基因的表达而广泛调控细胞的生命活动。Menin的功能突变或缺失导致多发性内分泌腺瘤病Ⅰ型(MEN1),对于机体的代谢具有重要的调控功能。例如,肝组织特异性Menin缺失或肝细胞特异性Menin缺失都易发(非酒精性)脂肪肝,同时伴随胰岛素抵抗和Ⅱ型糖尿病表型。这表明Menin与肝脏代谢稳态之间的潜在联系。该研究发现Menin可以调控肝细胞的代谢稳态,“运筹帷幄”肝脏糖代谢与脂代谢之间的局势,扮演“谋局者”的角色。肝细胞Menin既可以通过与细胞能量传感器SIRT1、PPARγ相互作用来靶向脂质转运蛋白Fabp3/4/5以及Cd36的表达,从而调控脂质的吸收与代谢;又可以与FoxO1相互作用来靶向Gk、Pck的表达,从而调控葡萄糖的吸收与代谢。不仅如此,Menin还可以募集和部署这些互作蛋白在胞质/胞核中的分布,通过协调肝细胞对葡萄糖和脂肪酸的摄取进而调控细胞的代谢稳态。
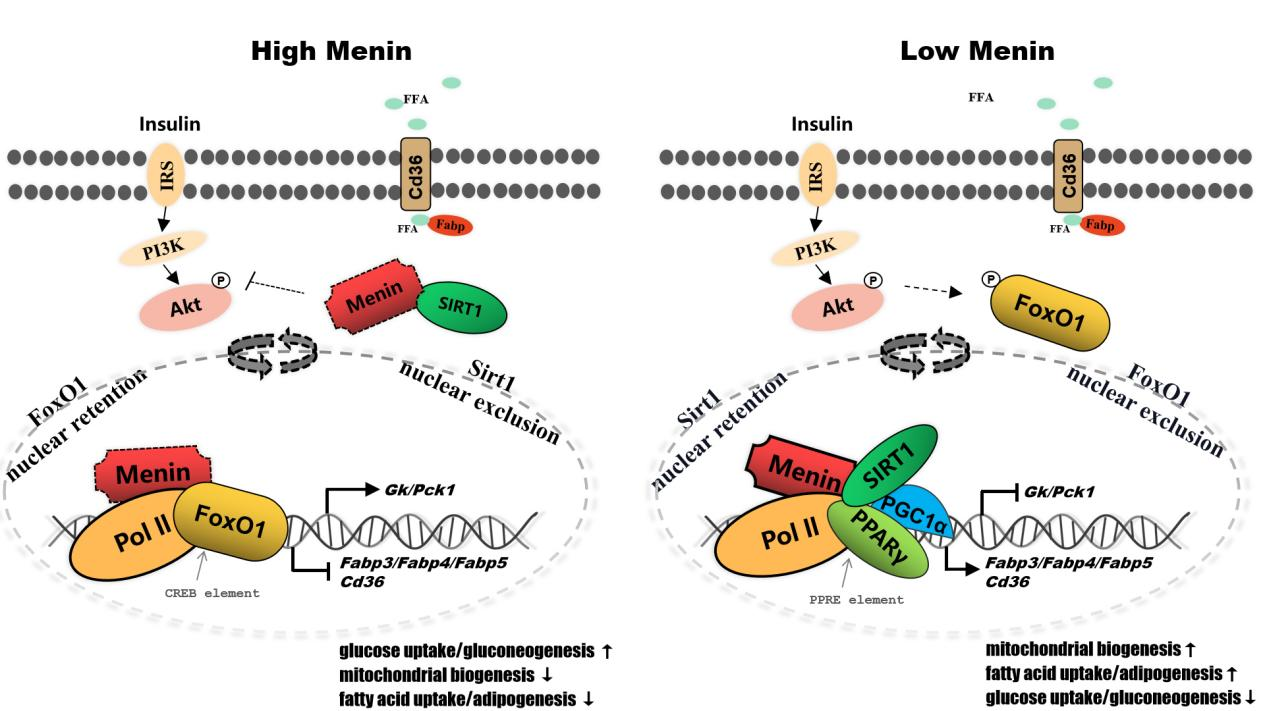
该研究是该课题组继解析了Menin介导乳腺代谢机制之后的新作。近年Menin因其广泛参与细胞的代谢调节活动而作为人类多种疾病的药物研发靶标。在肝脏中,Menin的表达失调是导致肝细胞糖脂代谢紊乱、形成脂肪沉积的重要因素。Menin部署肝细胞中FoxO1/PPARγ/SIRT1上的作用模型,也与美国糖尿病协会提出的最新建议不谋而合——用PPARγ激动剂(吡格列酮)和胰高血糖素样肽-1(GLP1)受体激动剂治疗糖尿病、NAFLD或NASH(非酒精性脂肪性肝炎)。该研究论文为我们理解脂肪肝的发病机制提供新的认识,同时,为靶向Menin治疗脂肪肝(NAFLD、MAFLD)及其它肝病(NASH)提供了理论支撑。
课题组自2013年开始聚焦于奶牛围产期脂肪肝的发生与预防,该论文是脂肪肝发生分子机制的又一突破。同时,课题组研发的系列无创新型标志物可用于脂肪肝发生奶牛的诊断与提前预警/预防,获得3项授权国际发明专利和4项授权国家发明专利、申请发明专利3项(包括1项美国发明专利)。研究先后得到了国家自然科学基金、国家重点研发计划课题、山东省农业良种工程项目和山东省自然科学基金的资助。
编 辑:万 千
审 核:贾 波









